二-(2-乙基己基)二硫代磷酸(D2EHDTPA) 单独萃取金属离子,磷类萃取剂与螯合 萃取剂N530的协同萃取体系,而用 D2EHDTPA和N530对二阶阳离子钯的协同萃取机理比较少。本文系统地研究了D2EHDTPA与N530的氯仿溶液,从高氯酸介质中对二阶阳离子钯的协同 萃取机理。求得了协同萃取反应的平衡常数及热 力学函数值,取得了满意的结果。通过2-羟基-4-仲辛基-二苯甲酮肟(N530)与二-(2-乙基己基)二硫代磷酸(D2EHDTPA)的 氯仿溶液,从高氯酸介质中对钯协同萃取的研究,采取斜率法确定了萃合物的组成为:L·Pd·A。协同 萃取反应平衡常数为lgK=1.67,协同萃取配合物生成常数为β=1.71。同时计算了协同萃取反应 的热力学函数值,△H=16.81千焦/摩尔,△S=88.0焦/(摩尔·K),△G=-9.42千焦/摩尔。
1、试剂与溶液
1.1、试剂D2EHDTPA(自制),纯度不低于99%,记为 HL;N530;二阶阳离子钯;其它试剂均为分析纯。
1.2、溶液
钯溶液:称取一定量二氯化钯,用少许浓度为 2.0摩尔/升的盐酸溶解,加入氢氧化钠溶液使钯呈氢氧化钯炭沉淀,抽滤、洗涤除去氯阴氢离子后用高氯酸 (1.0摩尔/升)溶解,调至所需pH值,用碘化钾分光光 度法标定后备用。
2、主要仪器
721型分光光度计;pHs-3c型酸度计; THZ-813型恒温振荡器,(t±0.5)度。
3、实验方法
将等体积的两相置于分液漏斗中,除温度效 应外均在(25±0.5)度恒温振荡器内振荡30 分钟,静止分层后,取样测定萃余水相中钯的浓 度,用差减法求出有机相平衡钯浓度,依此计算萃 取和分配比D。水相钯浓度采用碘化钾分光光度法测定。
3.1、N530萃取二阶阳离子钯的机理
N530(记为H2A)从高氯酸溶液中萃取二阶阳离子钯 的反应为:
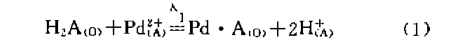
3.2、D2EHDTPA(记为HL)萃取二阶阳离子钯的机理:
![]()
3.3、 N530如与D2EHDTPA氯仿溶液协同萃 取二阶阳离子钯的正协同萃取
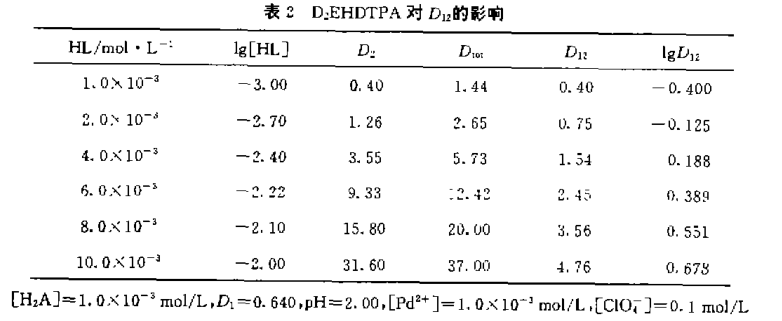
为了确定该体系有无执萃效应,实验中固定 有机相“N530+HL”的总浓度为0.0010摩尔/升, 溶液[高氯酸]=0.10摩尔/升,改变“N530+HL”浓 度比,结果得正协同效应。由表1可见,N530+HL 体系的最佳协同萃取点为:
![]()

3.4、“N530+HL”氯仿体系对钯协同革取 的机理及平衡常数的计算
由D2EHDTPA萃取二阶阳离子钯的反应,假设该体 系的协同萃取反应为:
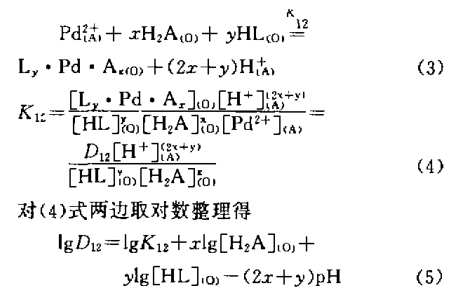
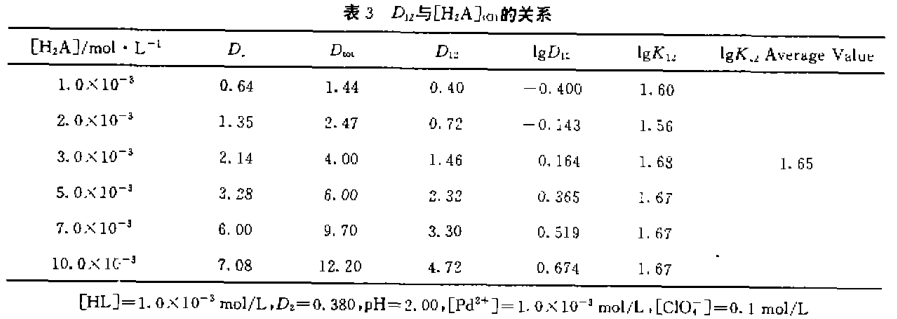
实验中固定水相组成及N530浓度,改变HL浓度,得到一系列分配比D,同样,固定水相组 成及HL度,改变N530浓度,又得一系列分配比 D,根据二元协同萃取分配比D12=Dto1-D1- D2,实验数据列表2、表3。lgD12分别对lg[HL]和lg[H2A]的一元回归方程为:

将相应的lgD12、lg[H2A]、lg[HL]值(见表3)代入(7)式求得平衡常数平均值为
![]()
有机相中协同萃取配合物的生成反应为:
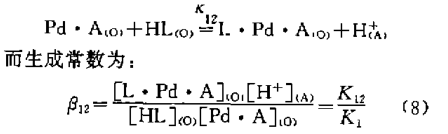
在实验条件下,H2A萃取二阶阳离子钯的平衡常数 ,列人表4。
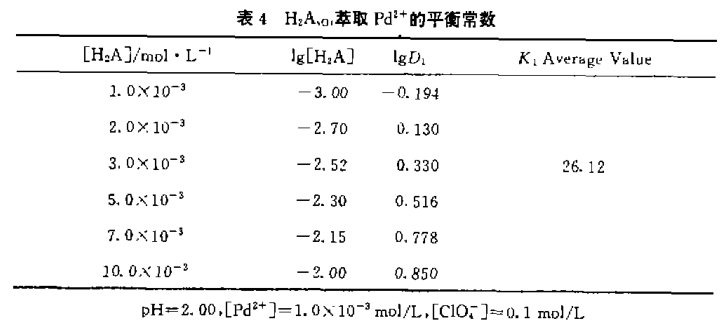
将K1、K12值代入(8)式求得生成常数
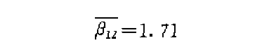
3.5、温度对协同革取分配比的影响
为了研究“N530+HL”氯仿体系对二阶阳离子钯协同 萃取的热效应,测定了上述萃取体系在不同温度 下二阶阳离子钯的协同萃取分配比D12,列于表5,lgD12对 1/T一元回归方程为:
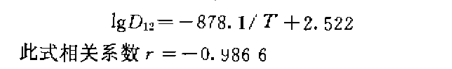
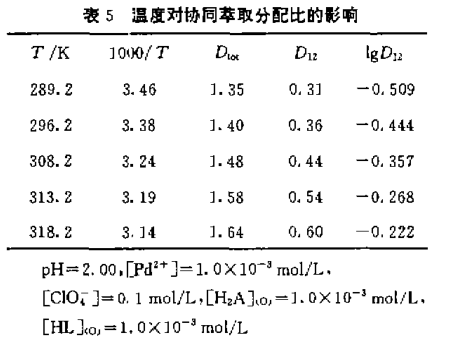
从回归方程可见,该萃取体系为放热反应,升 高温度对萃取不利。并由
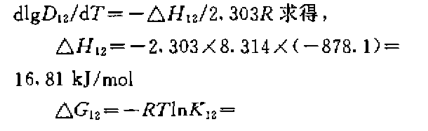
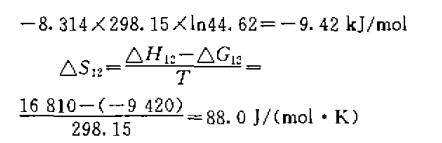
 钯碳回收
钯碳回收
